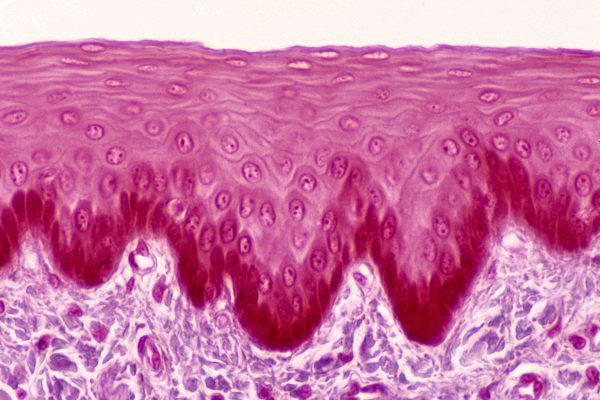
Eosinofiele oesofagitis is een chronische, progressieve type 2-inflammatoire aandoening van de slokdarm en komt frequent voor bij kinderen. Zonder adequate behandeling kan de aandoening leiden tot oesofageale fibrose en een verminderde kwaliteit van leven.1 Dupilumab, een volledig humaan monoklonaal antilichaam dat centrale routes van type 2-inflammatie blokkeert, heeft in de fase III-studie EoE KIDS significante verbeteringen laten zien in zowel histologische als endoscopische uitkomstmaten bij kinderen van 1-11 jaar met actieve eosinofiele oesofagitis.1,2 Tijdens EAACI 2025 presenteerde dr. Antonella Cianferoni (Children’s Hospital of Philadelphia, Philadelphia, VS) de resultaten van een post-hocanalyse van deze studie, met bijzondere aandacht voor de invloed van individuele atopische comorbiditeit op de behandelrespons.2
Eosinofiele oesofagitis (‘eosinophilic esophagitis’, EoE) is een chronische inflammatoire aandoening van de oesofagus, aangedreven door een type 2-immuunrespons waarin eosinofiele ontsteking een centrale rol speelt.1 Vanwege overeenkomende pathofysiologische mechanismen komt EoE vaak voor in combinatie met atopische comorbiditeit, zoals atopische dermatitis, astma, allergische rinitis en voedselallergieën.3 Dupilumab is een volledig humaan monoklonaal antilichaam dat de interleukine-4- en interleukine-13-signaalroutes, twee cruciale mediatoren van type 2-inflammatie, blokkeert.4 Eerder werd de therapie al goedgekeurd voor adolescenten en volwassenen met een lichaamsgewicht van ten minste 40 kg.1,5 Inmiddels is dupilumab ook goedgekeurd voor de behandeling van EoE bij kinderen vanaf één jaar met een minimumgewicht van 15 kg in zowel de EU als de VS.2 Uit deel A van de fase III-studie EoE KIDS, waarin dupilumab werd onderzocht bij kinderen van 1 tot 11 jaar met actieve EoE die niet reageerden op een behandeling met protonpompremmers, is gebleken dat behandeling met dupilumab resulteerde in significante verbeteringen van histologische, endoscopische en transcriptomische uitkomstmaten ten opzichte van placebo.1,2 Tijdens het EAACI-congres 2025 werden de resultaten gepresenteerd van een post-hocanalyse van deze studie. De analyse had tot doel de werkzaamheid van gewichtsafhankelijke toediening van dupilumab versus placebo te evalueren bij kinderen van 1 tot 11 jaar met EoE, uitgesplitst naar de aanwezigheid van specifieke atopische comorbiditeit bij aanvang van de studie.2
De gerandomiseerde, placebogecontroleerde fase III-studie EoE KIDS bestond uit twee delen. In deel A werden patiënten gerandomiseerd tussen één van vier behandelgroepen: op gewicht gebaseerde lage of hoge blootstelling aan dupilumab, of een overeenkomstige lage of hoge blootstelling aan placebo, gedurende een dubbelblinde behandelperiode van 16 weken. Deel B betrof een extensie van 36 weken voor patiënten die deel A hadden voltooid.
In deze analyse van de EoE KIDS-studie werden kinderen uit deel A geïncludeerd met een minimumgewicht van 15 kg, die gedurende 16 weken behandeld waren met een op gewicht gebaseerde hoge dosis dupilumab of met placebo (ongeacht de blootstellingsintensiteit). Hierbij werd ook gekeken naar subgroepen met atopische comborbiditeit zoals: atopische dermatitis, astma, allergische rinitis en voedselallergieën.
De uitkomstmaten omvatten het percentage patiënten dat ‘peak eosinophil counts’ (PEC) van ≤6 en <15 eosinofielen per ‘high-power field’ (eos/hpf) bereikte, de gemiddelde veranderingen in de ‘Endoscopic Reference Score’ (EREFS), de ‘EoE Histology Scoring System’ (EoEHSS)-score voor zowel graad als stadium, en het aandeel dagen met ≥1 EoE-symptoom, gemeten met de ‘Pediatric Eosinophilic Esophagitis Sign/Symptom Questionnaire – Caregiver version’ (PESQ-C), ten opzichte van placebo.
In totaal werden 61 patiënten gerandomiseerd tussen een behandeling met dupilumab (n=32) of placebo (n=29). Bij aanvang van de studie waren patiëntkarakteristieken over het algemeen vergelijkbaar tussen de behandelgroepen. De gemiddelde leeftijd bedroeg 7,4 jaar in de dupilumab-groep en 8,1 jaar in de placebogroep. Ten tijde van inclusie hadden 32 kinderen (100%) in de dupilumab-groep ten minste één atopische comorbiditeit, vergeleken met 26 kinderen (89,7%) in de placebogroep.
Na 16 weken behandeling leidde dupilumab, ongeacht de aanwezigheid van specifieke atopische comorbiditeit, tot een grotere proportie patiënten met een PEC ≤6 eos/hpf vergeleken met placebo. Wanneer geanalyseerd per comorbiditeit bedroeg het verschil ten opzichte van placebo respectievelijk bij patiënten met en zonder atopische dermatitis: 73,7% (95%-BI: 53,9-93,5) vs. 45,5% (95%-BI: 14,2-76,8), bij patiënten met en zonder astma: 53,7% (95%-BI: 29,7-77,8) vs. 77,8% (95%-BI: 50,6-100,0), bij patiënten met en zonder allergische rinitis: 60,1% (95%-BI: 39,3-81,0) vs. 66,7% (95%-BI: 29,0-100,0), en bij patiënten met en zonder voedselallergie: 61,0% (95%-BI: 40,9-81,1) vs. 66,7% (95%-BI: 29,0-100,0).
Daarnaast bereikten meer patiënten in de dupilumab-groep PEC <15 eos/hpf ten opzichte van patiënten in de placebogroep, ongeacht de aanwezigheid van een specifieke atopische comorbiditeit. Voor respectievelijk patiënten met en zonder comorbiditeit (atopische dermatitis, astma, allergische rinitis en voedselallergie) werden de volgende procentuele verschillen ten opzichte van placebo gerapporteerd: 94,7% (95%-BI: 84,7-100,0) vs. 53,2% (95%-BI: 22,5-83,9), 66,8% (95%-BI: 44,3-89,2) vs. 100,0%, (95%-BI: 100,0-100,0), 75,5% (95%-BI: 57,3-93,7) vs. 83,3% (95%-BI: 53,5-100,0) en 76,4% (95%-BI: 59,1-93,7) vs. 83,3% (95%-BI: 53,5-100,0).
Tevens werden verbeteringen in zowel de EREFS als de EoEHSS-graad- en stadia-scores in vergelijking met placebo gerapporteerd binnen alle subgroepen. Ook werd over het algemeen een afname gezien in het percentage dagen met ≥1 EoE-symptoom, aan de hand van de PESQ-C. Het veiligheidsprofiel van dupilumab kwam overeen met wat eerder bekend was.
Behandeling met dupilumab resulteerde in verbeterde histologische en endoscopische uitkomsten bij kinderen van 1 tot 11 jaar met EoE en een lichaamsgewicht ≥15 kg, vergeleken met placebo, ongeacht de aanwezigheid van afzonderlijke atopische comorbiditeit. Deze bevindingen onderstrepen de brede toepasbaarheid van dupilumab bij deze groep kinderen.
Referenties